A poco más de un año de la llegada del virus SARS-COV-2 hemos aprendido a vivir con él y buscar nuevas formas de salir adelante, pese al cambio radical que implicó su dispersión acelerada en el mundo y la sociedad.
Hoy en día, ya contamos con diferentes vacunas para contrarrestar el avance de la enfermedad y estudios científicos para aplicar distintos tratamientos en pacientes contagiados.
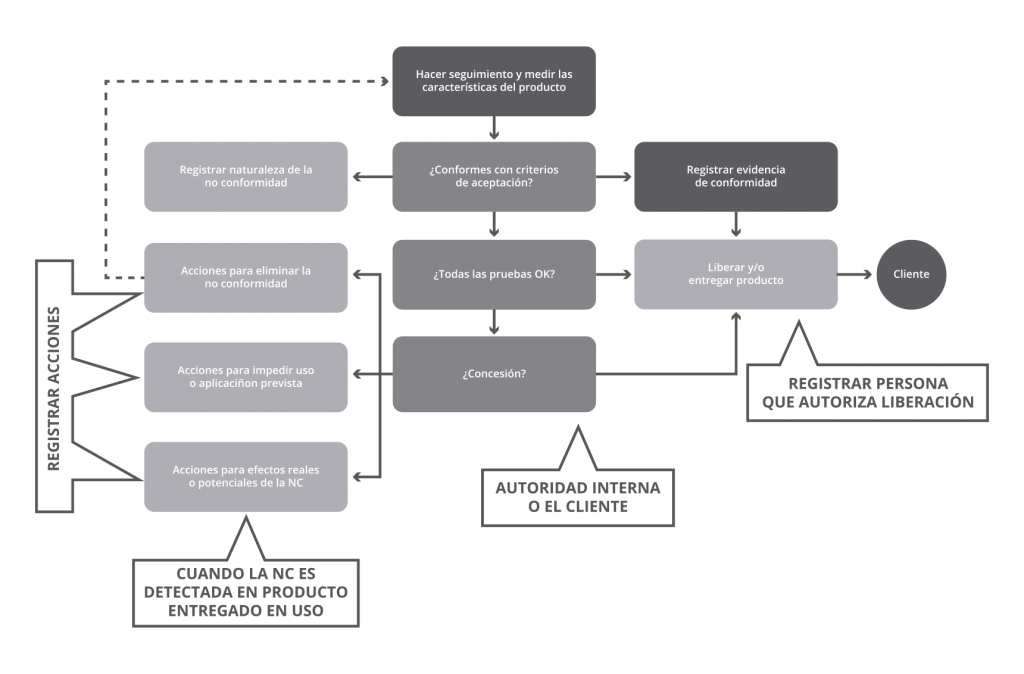
Y así como se han creado herramientas para luchar en el frente, también están llegando otras para controlar la pandemia, para ello tenemos los estándares. Es bien sabido que la liberación de un nuevo estándar toma años, sin embargo, la pandemia ha provocado que actuemos de manera rápida y eficaz, logrando nuevos estándares para su inmediata aplicación con el fin de combatir las circunstancias actuales. Conozcamos los nuevos estándares de ISO que nos ayudarán a establecer un curso de acción efectivo para poder salvar vidas.
WA IWA 36 (En desarrollo)
Orientación para el servicio de entrega sin contacto
El documento IWA apunta a:
- Evitar el riesgo de exposición del mensajero y garantizar la seguridad de los consumidores y el mensajero para tener un consumo seguro.
- Promover la protección de la información personal, respetando la privacidad del consumidor.
- Conocer la diversificación de los consumidores y personalizar las necesidades de consumo.
- Proveer el modelo de servicio de “Entrega sin contacto” y guía al mercado.
AWA IWA 38 (En desarrollo)
Orientación para la construcción de un área médica de emergencia
La guía es apropiada para áreas médicas de emergencia dedicadas al tratamiento de enfermedades respiratorias infecciosas, construidas rápidamente utilizando tableros móviles en contenedores o estructuras de acero.
AWI IWA 40 (En desarrollo)
Orientación para servicios de cocina virtual
La cocina virtual es un servicio de cocina que se enfoca en los servicios alimenticios para entrega de comida o recoger en el establecimiento.
La cocina virtual ha hecho un aporte significativo a la recuperación de la industria tradicional de abastecimiento de comida, ya que provee una importante garantía para reanudar la producción durante la pandemia.
La cocina virtual hace que los servicios de comida tradicional se conviertan en comida para llevar, reduciendo la pérdida de los restaurantes. La cocina virtual es más apropiada para el estilo de vida rápida.
ISO/WD 22393 (En desarrollo)
Seguridad y resiliencia
Esta propuesta tiene como objetivo abordar, a corto plazo, los efectos inmediatos de COVID-19 a través de planes robustos con respecto a:
- Reiniciar servicios básicos.
- Vida social del público.
- Soporte a los ancianos y a los más vulnerables.
- Apertura de escuelas.
- Regreso de los servicios de viaje.
- Recuperación económica de retails y sectores restauranteros más afectados – Medidas de distanciamiento social.
La propuesta también apunta, a largo plazo, a recrear una sociedad en la que se aborden objetivos internacionales a largo plazo y mejorar la sociedad en conjunto. Apunta a las deficiencias sociales que agravaron el impacto de la pandemia, y:
- Deficiencias de las estrategias a la hora identificar a COVID-19 como un riesgo.
- Creando una sociedad más sostenible, protegiendo espacios verdes y construyendo infraestructura para mantener las emisiones de CO2 a niveles bajos.
- Estableciendo un mayor gasto en los recursos clave de los servicios del sector público. Mejorando la protección de lugares verdes.
- Legislación de emergencia que proporcione vivienda a las personas sin hogar.
- Establecer áreas de oportunidad para la construcción de una sociedad más sostenible y equitativa.
- Tecnología digital para los sectores de atención primaria.
- Mantenimiento en los niveles de voluntariado y comunidad activista.
ISO/AWI 34019 (En desarrollo)
Seguridad alimentaria
Guía de emergencia o situación de crisis.
Esta propuesta tiene como objetivo establecer los requerimientos mínimos para la coordinación, preparación y distribución de comida para personas afectadas por una situación de emergencia, desastre o crisis.
ISO/AWI 5477 (En desarrollo)
Salud informática – Portafolio estándar de referencia (RSP) – Sistema de información de preparación y respuesta ante emergencias de salud pública – Sistema de información RSP-PH EPR
Esta norma describe el portafolio estándar de referencia para los negocios de tecnologías de la información, es estándar de salud interoperable.
ISO/FDIS 80601-2-90 (En desarrollo)
Equipo médico eléctrico
Este documento se aplica a la seguridad básica y el rendimiento esencial de los equipos de terapia ventilatoria de alto flujo, como se define en la cláusula 201.3.204 de la ISO/DIS 80601-2-90, de ahora en adelante referido como equipo ME, en combinación con:
- Destinado al uso en ambientes para el cuidado de la salud en el hogar.
- Destinado para el uso en instalaciones profesionales del cuidado de la salud.
- Destinado para ser usado por un operador o un operador profesional en el cuidado de la salud.
- Destinado para usare con pacientes que pueden respirar espontáneamente.
- Destinado para pacientes que se beneficiarían de un mejor intercambio de gases alveolares.
- Beneficiarios de recibir gases respiratorios humidificados de alto flujo, incluyendo pacientes cuyas vías respiratorias superiores se desvíen.
ISO/WD TR 5202 (En desarrollo)
Edificios y trabajos civiles de ingeniería
Este documento tendrá la tarea de recolectar y registrar la información relacionada con múltiples edificios de emergencias de salud pública de todo el mundo, incluyendo los registros y la investigación de casos típicos, medición de emergencias y lineamientos, reflexiones e investigaciones sobre la mejora del rol que juegan estos edificios. Estándares y marcos emitidos por los gobiernos locales, nacionales, entre otros. Durante y después de la emergencia sanitaria.
Estamos deseosos de que dichas normas puedan llegar a nuestras manos lo más pronto posible para seguir con el combate contra la pandemia.