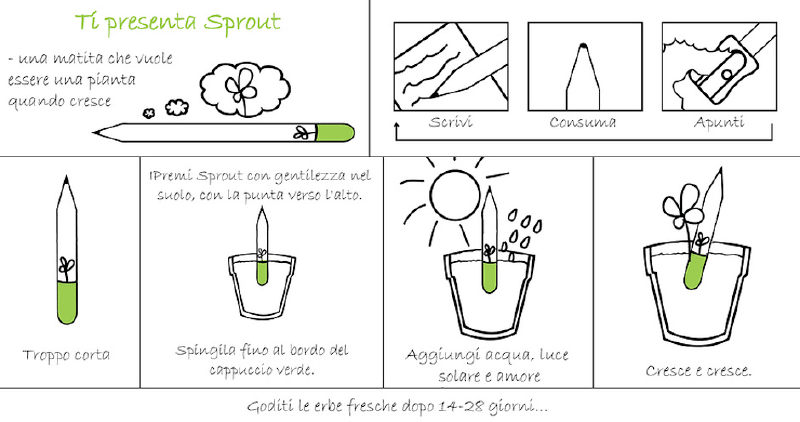
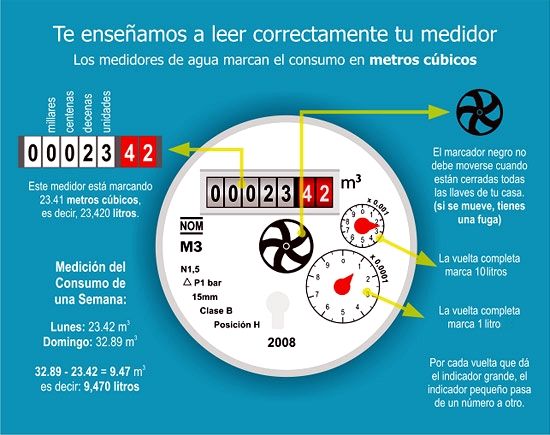
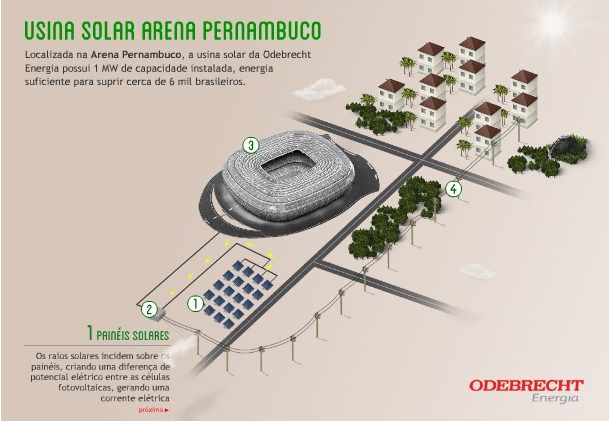
El fútbol es más que solo deporte, en algunos países es una religión, se tiene culto a los jugadores. Es una afición que posee de gran atención, y el ganar un partido en un país ajeno es motivo de celebraciones nacionales. Además es una industria de millones de dólares. No debería de sorprender el hecho de que exista una familia de estándares enfocados en mejorar la experiencia de juego, el desempeño y el negocio como en cualquier otra industria.
El preparar una competencia a nivel mundial implica un gran reto, y sin duda uno de los principales es el contar con las condiciones adecuadas de seguridad para jugadores y aficionados. A través de la participación de personas de todo el mundo se realizan acuerdos sobre los niveles de seguridad, calidad y servicio. Puede que estos acuerdos transformados en estándares no sean perceptibles, no son el centro de atención del mundial, pero están; es por ello que existen requisitos para la portería, el balón, los asientos del estadio, iluminación y hasta la cerveza que se consume.
¿Quiénes crean estos estándares?
https://www.youtube.com/watch?v=NNu1CgAbdiE
El Comité Europeo de Estandarización (CEN) es uno de los tres organismos europeos de normalización junto a CANELEC y ETSI, siendo reconocidos oficialmente por la Unión Europea y por la Asociación Europea de Libre Comercio como responsable de desarrollar los Estándares Europeos (EN) tanto para fútbol como para otros campos de acción a través de su comité técnico. Todo esto resulta muy familiar si lo equiparamos al proceso de desarrollo de normas ISO.
Los protagonistas

Se desarrollaron varios estándares para garantizar lo antes mencionado, sin embargo los principales, aquellos que son fundamentales para el alto desarrollo de esta justa deportiva son los siguientes:
- Balón: El balón de Brasil 2014 excede por mucho los requerimientos solicitados por la FIFA, adicionado a ellos, cumple con los requerimientos del estándar EN 12235, que hacen hincapié en las pruebas previas a ser aprobado, como el rebote, si se deja caer desde una altura de 2 metros sobre una superficie de hormigón, el balón deberá responder con un rebote de 1.35 metros.
- Portería: El estándar EN 748 determina las especificaciones para la malla, la cuerdafutque la sujeta a la portería, los postes y las dimensiones de la meta. El hilo debe de tener un diámetro mínimo de 2mm y el tamaño aproximado de la malla es de 12 cm. Las dimensiones de la portería deben ser de 7.32 x 2.44 metros.
- Pasto: A pesar de que en Brasil no se utilizó el pasto artificial para vestir los campos de juego, el estándar EN 12233 que determina las características para este, ayuda a que el pasto natural tenga una altura estandarizada, la cual corresponde a los 23 mm.
- Guantes: De acuerdo al la norma EN 16027 que hace referencia a la ropa de protección, los guantes del guardameta nunca deberán de resbalarse de las manos y deben de ser ligeramente mas grandes que éstas. Todo, para proporcionar una mayor capacidad de bloqueo.
- Asientos: Apegados al estándar EN 13200-4 los asientos de los estadios deben ser capaces de soportar un peso de 2000 kg, contar con un mínimo de 40 cm de profundidad y 50 cm de ancho.
- Iluminación: Los expertos determinaron los requisitos de iluminación; de acuerdo al estándar EN 12193, el área alrededor del campo, en donde las cámaras se encuentran posicionadas, deberá de ser 0.25 veces más brillante, todo esto para poder transmitir vía televisión una imagen más nítida e iluminada.
Estos son tan solo algunos de los ejemplos y por mencionar quedan bastantes, como el equipo médico que atiende las emergencias en el campo de juego, la comida, las bebidas, etc., necesitaríamos crear un sitio especial para hacer mención de cada una de ellas. De algo estamos seguros, con el paso de los años, y el avance tecnológico, serán cada día más necesarios estos estándares y se desarrollarán nuevos como base para el desarrollo de los siguientes mundiales. Nos vemos en Rusia 2018